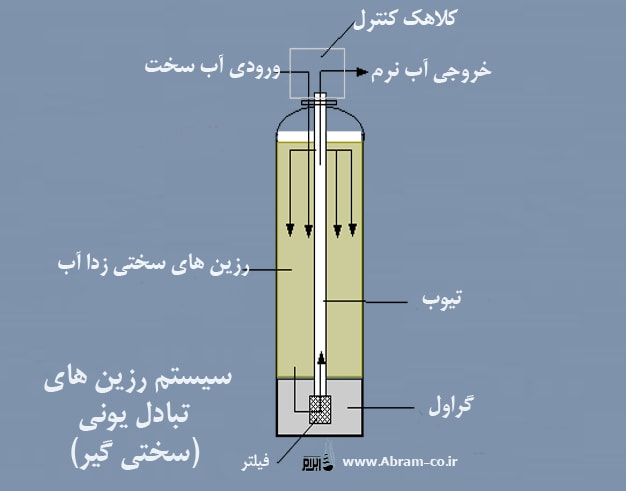
روش احیا رزین کاتیونی
روش احیا رزین کاتیونی
روش احیا رزین کاتیونی تابعی از واکنش های رخ داده و تعادل های شیمیایی است که در آن یک یون انتخابی در محل ، تبادل یونی شده جایگزین یون دیگر می شود. تبادل کاتیون رو چرخه ی سدیم را می توان با واکنش زیر نشان داد:
+Na2.R + Ca2+ => Ca+.R + Na
در اینجا R معرف رزین تبادل می باشد. وقتی تمام محل های تبادل بوسیله کلسیم گرفته شد با عبور محلول غلیظ یون سدیم از بستر ، رزین را احیا می کنند. روش احیا رزین کاتیونی جهت تعادل را عوض کرده و کلسیم را با سدیم جایگزین می کند. برای احیا رزین معمولا از محلول نمک ۵تا۱۰ درصد استفاده می شود.
+Ca.R + 2Na+ => Na2.R + Ca2
نظیر همین واکنش ها برای تبادل کاتیون روی چرخه هیدروزن رخ می دهد.
+H2.R + Ca2+ => Ca+.R + 2H
در نتیجه احیا با محلول ۲تا ۱۰ درصد هیدروزن سولفید خواهیم داشت:
+Ca.R + 2H+ => H2.R + Ca2
روش احیا رزین آنیونی برای آنیون ها نیز با یون های هیدروکسیل جایگزین می شود.
-So4 + R(OH)2 => So4.R + 2OH
احیا با محلول ۵تا ۱۰ درصد هیدروکسید سدیم ، محل های تبادل را تجدید خواهد کرد:
So4.R + 2OH- => So4 + R(OH)2
علاوه بر عامل غلظت، ماهیت تبادل گر و یون های مبادله شده ، عواملی نظیر دما و اندازه ذرات تبادل گر نیز اهمیت قابل ملاحظه ای دارد. درجه تبادل به چندین عامل بستگی دارد.
- اندازه و والانس بار یون هایی که در تبادل نقش دارند.
- غلظت یون های آب یا محلول
- ماهیت فیزیکی و شیمیایی ماده مورد تبادل یونی
- دما
ترتیب زیر انتخاب گری و سهولت تبادل کاتیون ها را نشان می دهد.
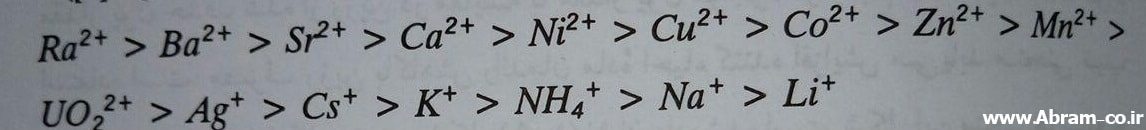
بنابراین رادیوم مورد تمایل ترین کاتیون و لیتیم کم متقاضی ترین کاتیون است. ترتیب زیر میزان انتخاب گری تبادل آنیون های را نشان می دهد.
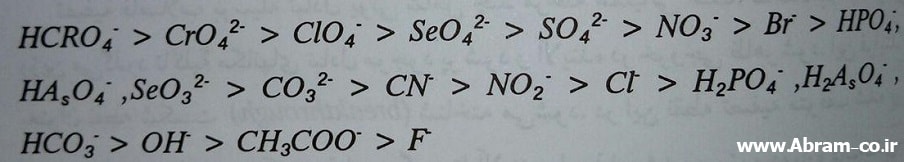
کم متقاضی ترین آنیون ، کمترین زمان ماند را داشته و قبل از بقیه در خروجی ظاهر می شود و مورد تمایل ترین آنیون با بیشترین زمان ماند بعد از دیگران در خروجی ظاهر می شود.
عملکرد اقتصادی و تعیین بهینه بودن یا نبودن سیستم های رزینی بستگی به نوع رزین و همچنین مقدار ماده مورد نظر برای احیا بستگی دارد.